Thành phần
Hoạt chất:
Mỗi viên nén JANUVIA chứa 128,5mg sitagliptin phosphat monohydrat, tương đương với 100mg theo thứ tự, dạng base tự do.
Tá dược:
Mỗi viên nén bao phim JANUVIA chứa các tá dược sau đây: cellulose vi tinh thể, anhydrous dibasic calci phosphat (calci hydrogen phosphat dạng khan), croscarmellose natri, magnesi stearat và natri stearyl fumarat. Ngoài ra, lớp bao phim chứa các tá dược sau đây: polyvinyl alcol, polyethylene glycol (macrogol), talc, titan dioxyd, sắt oxyd màu đỏ và sắt oxyd màu vàng.
Công dụng (Chỉ định)
Đơn trị liệu
JANUVIA được dùng như liệu pháp hỗ trợ cho chế độ ăn kiêng và vận động thể lực để cải thiện kiểm soát đường huyết ở bệnh nhân đái tháo đường týp 2.
Kết hợp với Metformin
JANUVIA được chỉ định ở bệnh nhân đái tháo đường týp 2 để cải thiện kiểm soát đường huyết bằng cách kết hợp với metformin như liệu pháp ban đầu hoặc khi metformin đơn trị liệu cùng chế độ ăn kiêng và vận động thể lực không kiểm soát được đường huyết thích đáng.
Kết hợp với một sulfamid hạ đường huyết
JANUVIA được chỉ định ở bệnh nhân đái tháo đường týp 2 để cải thiện kiểm soát đường huyết bằng cách kết hợp với sulfamid hạ đường huyết đơn trị liệu cùng chế độ ăn kiêng và vận động thể lực không kiểm soát được đường huyết thích đáng.
Kết hợp với chất chủ vận PPARγ
JANUVIA được chỉ định ở bệnh nhân đái tháo đường týp 2 để cải thiện kiểm soát đường huyết bằng cách kết hợp với chất chủ vận PPARγ (như nhóm thiazolidinediones) khi chất đồng vận PPARγ đơn trị liệu cùng chế độ ăn kiêng và vận động thể lực không kiểm soát được đường huyết thích đáng.
Kết hợp với Metformin và một sulfamide hạ đường huyết
JANUVIA được chỉ định ở bệnh nhân đái tháo đường týp 2 để cải thiện kiểm soát đường huyết bằng cách kết hợp với metformin và một sulfamide hạ đường huyết khi hai loại thuốc này cùng chế độ ăn kiêng và vận động thể lực không kiểm soát được đường huyết thích đáng.
Kết hợp với Metformin và một chất chủ vận PPARγ
JANUVIA được chỉ định ở bệnh nhân đái tháo đường týp 2 để cải thiện kiểm soát đường huyết bằng cách kết hợp với metformin và một chất chủ vận PPARγ (như thiazolidinediones) khi hai loại thuốc này cùng chế độ ăn kiêng và vận động thể lực không kiểm soát được đường huyết thích đáng.
Kết hợp với Insulin
JANUVIA được chỉ định ở bệnh nhân đái tháo đường týp 2 như một liệu pháp hỗ trợ cho chế độ ăn kiêng và vận động thể lực để cải thiện kiểm soát đường huyết khi dùng kết hợp với insulin (cùng hoặc không cùng metformin).
Cách dùng - Liều dùng
Liều JANUVIA khuyến cáo là 100mg, ngày 1 lần khi dùng như đơn trị liệu hoặc kết hợp với metformin, sulfamide hạ đường huyết, insulin (cùng hoặc không cùng metformin), chất chủ vận PPARγ (như thiazolidinediones), hoặc metformin cùng sulfamide hạ đường huyết hoặc có thể dùng metformin cùng chất chủ vận PPARγ. Có thể uống JANUVIA cùng hoặc không cùng với thức ăn.
Khi dùng JANUVIA kết hợp với sulfamide hạ đường huyết hoặc insulin, có thể xem xét dùng sulfamide hạ đường huyết hoặc insulin liều thấp hơn nhằm giảm nguy cơ hạ đường huyết do sulfamide hạ đường huyết (xem THẬN TRỌNG, Hạ đường huyết khi kết hợp với sulfamide hạ đường huyết hoặc insulin).
Bệnh nhân suy thận
Vì có sự điều chỉnh liều lượng dựa trên chức năng thận, nên đánh giá chức năng thận trước khi bắt đầu dùng JANUVIA và định kỳ sau đó.
Đối với bệnh nhân suy thận nhẹ (tỷ lệ lọc cầu thận ước tính [eGFR] ≥ 60 mL/phút/1,73 m2 đến < 90 mL/phút/1,73m2), không cần chỉnh liều JANUVIA.
Đối với bệnh nhân suy thận trung bình (eGFR ≥ 45 mL/phút/1,73m2 đến < 60 mL/phút/1,73m2 ), không cần chỉnh liều JANUVIA.
Đối với bệnh nhân suy thận trung bình (eGFR ≥ 30 mL/phút/1,73m2 đến < 45 mL/phút/1,73m2), liều JANUVIA là 50mg ngày 1 lần.
Đối với bệnh nhân suy thận nặng (eGFR ≥ 15 mL/phút/1,73m2 đến < 30 mL/phút/1,73m2) hoặc có bệnh thận giai đoạn cuối (eGFR < 15 mL/phút/1,73m2), bao gồm các bệnh nhân cần thẩm tách máu hoặc thẩm phân phúc mạc, liều JANUVIA là 25mg ngày 1 lần. Có thể dùng JANUVIA bất kỳ lúc nào, không liên quan đến thời điểm thẩm tách máu.
Không sử dụng trong trường hợp sau (Chống chỉ định)
Chống chỉ định dùng JANUVIA ở bệnh nhân quá mẫn với bất kỳ thành phần nào của thuốc (xem THẬN TRỌNG, Phản ứng mẫn cảm và TÁC DỤNG PHỤ, Kinh nghiệm hậu mãi).
Lưu ý khi sử dụng (Cảnh báo và thận trọng)
Tổng quát:
Không nên dùng JANUVIA bệnh nhân đái tháo đường týp 1 hoặc để điều trị nhiễm acid ceton ở bệnh nhân đái tháo đường.
Viêm tụy: Đã có các báo cáo về viêm tụy cấp, bao gồm viêm tụy xuất huyết hoặc hoại tử gây tử vong và không gây tử vong (xem TÁC DỤNG PHỤ) ở bệnh nhân dùng sitagliptin. Nên cho bệnh nhân biết triệu chứng đặc trưng của viêm tụy cấp là đau bụng dữ dội và liên tục. Viêm tụy được ghi nhận hồi phục sau khi ngưng dùng sitagliptin. Nếu nghi ngờ viêm tụy, nên ngưng dùng JANUVIA và các thuốc khác có thể liên quan.
Sử dụng ở bệnh nhân suy thận: JANUVIA được đào thải qua thận. Để đạt nồng độ JANUVIA trong huyết tương tương tự như ở bệnh nhân có chức năng thận bình thường, nên giảm liều thuốc ở bệnh nhân có eGFR < 45 mL/phút/1,73m2), cũng như ở bệnh nhân có bệnh thận giai đoạn cuối (ESRD) cần thẩm phân máu hoặc thẩm phân phúc mạc (xem LIỀU LƯỢNG VÀ CÁCH DÙNG, Bệnh nhân suy thận).
Hạ đường huyết khi dùng liệu pháp kết hợp với sulfamide hạ đường huyết hoặc insulin:
Trong các thử nghiệm lâm sàng với JANUVIA theo đơn trị liệu và theo trị liệu kết hợp với các thuốc được biết rõ không gây hạ đường huyết (như metformin hoặc chất chủ vận PPARγ
(thiazolidinediones)), tỷ lệ các báo cáo hạ đường huyết khi dùng JANUVIA tương tự như ở bệnh nhân dùng placebo. Giống như các thuốc trị tăng đường huyết khác, đã quan sát thấy hạ đường huyết khi dùng JANUVIA kết hợp với insulin hoặc sulfamide hạ đường huyết (xem TÁC DỤNG PHỤ). Do đó, để giảm nguy cơ hạ đường huyết do SU và insulin, có thể xem xét giảm liều SU hoặc insulin (xem LIỀU LƯỢNG VÀ CÁCH DÙNG).
Phản ứng quá mẫn: Đã có các báo cáo hậu mãi về những phản ứng quá mẫn nghiêm trọng ở bệnh nhân dùng JANUVIA. Các phản ứng này bao gồm phản ứng phản vệ, phù mạch và các bệnh lý tróc da kể cả hội chứng Stevens-Johnson. Vì các phản ứng này được báo cáo tự nguyện từ dân số chưa biết rõ cỡ mẫu, nên thường không thể ước tính chắc chắn tần suất hoặc xác lập mối quan hệ nhân quả với việc sử dụng thuốc. Các phản ứng này bắt đầu xuất hiện trong 3 tháng đầu sau khi bắt đầu điều trị với JANUVIA, với vài báo cáo xảy ra sau liều đầu tiên. Nếu nghi ngờ có phản ứng quá mẫn, phải ngưng dùng JANUVIA, đánh giá các nguyên nhân tiềm tàng khác và bắt đầu các trị liệu thay thế về bệnh đái tháo đường. (xem CHỐNG CHỈ ĐỊNH và TÁC DỤNG PHỤ, Kinh nghiệm hậu mãi).
Bóng nước Pemphigoid: Đã có báo cáo hậu mãi về các trường hợp bị bóng nước pemphigoid phải nhập viện điều trị đối với thuốc ức chế DPP-4. Trong các trường hợp được báo cáo, bệnh nhân thường được phục hồi bằng liệu pháp ức chế miễn dịch cục bộ hoặc hệ thống và ngưng dùng thuốc ức chế DPP-4. Khuyến cáo bệnh nhân báo cáo về sự phát triển của bóng nước hoặc trợt da trong khi dùng JANUVIA. Nếu nghi ngờ bóng nước pemphigoid, nên ngừng dùng JANUVIA và chuyển đến bác sỹ da liễu để được chẩn đoán và điều trị thích hợp.
Tác dụng không mong muốn (Tác dụng phụ)
Tóm tắt về tính an toàn của thuốc
Các tác dụng phụ nghiêm trọng bao gồm viêm tụy và các phản ứng quá mẫn đã được báo cáo. Hạ đường huyết đã được báo cáo khi dùng kết hợp với sulphonylurea (4,7% - 13,8%) và insulin (9,6%) (xem THẬN TRỌNG).
Bảng liệt kê các tác dụng phụ
Các tác dụng phụ được liệt kê dưới đây (Bảng 1) theo hệ cơ quan và tần suất. Tần suất được xác định như sau: Rất thường gặp (≥ 1/10); thường gặp (≥1/100 đến <1/10); ít gặp (≥1/1000 đến <1/100); hiếm gặp (≥1/10000 đến <1/1000); rất hiếm gặp (<1/10000) và chưa biết (không thể tiên đoán được từ dữ liệu hiện có).
Bảng 1. Tần suất các tác dụng phụ được xác định từ các nghiên cứu lâm sàng có đối chứng placebo với sitagliptin đơn trị liệu và kinh nghiệm hậu mãi
| Tác dụng phụ |
Tần suất tác dụng phụ |
| Rối loạn hệ miễn dịch |
| Các phản ứng quá mẫn bao gồm phản ứng phản vệ*,+ |
Chưa xác định tần suất |
| Rối loạn chuyển hóa và dinh dưỡng |
| Hạ đường huyết+ |
Thường gặp |
| Rối loạn hệ thần kinh |
| Đau đầu |
Thường gặp |
| Rối loạn tiêu hóa |
| Táo bón |
Thường gặp |
| Nôn* |
Chưa xác định tần suất |
| Viêm tụy cấp*,+,++ |
Chưa xác định tần suất |
| Viêm tụy xuất huyết và hoại tử gây tử vong và không gây tử vong*,+ |
Chưa xác định được tần suất |
| Rối loạn da và mô dưới da |
| Ngứa* |
Ít gặp |
| Phù mạch*,+ |
Chưa xác định tần suất |
| Phát ban*,+ |
Chưa xác định tần suất |
| Mày đay*,+ |
Chưa xác định tần suất |
| Viêm mao mạch*,+ |
Chưa xác định tần suất |
| Các bệnh lý gây tróc da kể cả hội chứng Stevens-Johnson*,+ |
Chưa xác định tần suất |
| Bóng nước pemphigoid* |
Chưa xác định tần suất |
| Rối loạn cơ xương và mô liên kết |
| Đau khớp* |
Chưa xác định tần suất |
| Đau cơ* |
Chưa xác định tần suất |
| Đau lưng* |
Chưa xác định tần suất |
| Rối loạn thận và tiết niệu |
| Suy thận cấp* |
Chưa xác định tần suất |
* Tác dụng phụ được xác định qua giám sát hậu mãi.
+ Xem Thận trọng.
++ Xem nghiên cứu TECOS đánh giá tính an toàn trên tim mạch bên dưới.
Mô tả một số tác dụng phụ chọn lọc
Ngoài các tác dụng phụ liên quan đến thuốc được mô tả ở trên, các tác dụng phụ đã được báo cáo bất kể mối quan hệ nhân quả với thuốc và xảy ra ở ít nhất 5% và nhiều hơn ở bệnh nhân đang điều trị với sitagliptin bao gồm nhiễm trùng đường hô hấp trên và viêm mũi họng. Các tác dụng phụ bổ sung sau đây đã được báo cáo bất kể mối quan hệ nhân quả với thuốc xảy ra thường xuyên ở bệnh nhân điều trị với sitagliptin (dưới 5%, nhưng tỷ lệ xảy ra với sitagliptin cao hơn 0,5% so với nhóm đối chứng) bao gồm viêm xương khớp và đau ở chi.
Một số tác dụng phụ được quan sát thấy thường xuyên ở các nghiên cứu sử dụng sitagliptin với các thuốc điều trị đái tháo đường khác hơn so với các nghiên cứu sử dụng sitagliptin đơn trị liệu. Bao gồm hạ đường huyết (tần suất rất thường gặp khi sử dụng kết hợp với sulphonulurea và metformin), cúm (thường gặp khi dùng với insulin (có hoặc không có metformin)), buồn nôn và nôn (thường gặp khi dùng với metformin), đầy hơi (thường gặp khi dùng với metformin hoặc pioglitazone), táo bón (thường gặp khi dùng kết hợp với sulphonylurea và metformin), phù ngoại biên (thường gặp khi dùng với pioglitazone hoặc phối hợp với pioglitazone và metformin), và tiêu chảy (ít gặp khi dùng với metformin).
Nghiên cứu TECOS đánh giá tính an toàn trên tim mạch
Nghiên cứu đánh giá kết cục trên tim mạch của sitagliptin (TECOS) tiến hành trên 7.332 bệnh nhân điều trị với sitagliptin, 100mg mỗi ngày (hoặc 50mg mỗi ngày nếu tốc độ lọc cầu thận ≥ 30 và < 50 mL/phút/1,73m2), và 7.339 bệnh nhân dùng placebo trong quần thể có ý định điều trị. Cả hai trị liệu được thêm vào chế độ chăm sóc thông thường nhằm kiểm soát mức HbA1c theo tiêu chuẩn khu vực và các yếu tố nguy cơ trên tim mạch. Dân số nghiên cứu bao gồm 2.004 bệnh nhân ≥ 75 tuổi (970 bệnh nhân điều trị với JANUVIA và 1.034 bệnh nhân dùng giả dược). Tần suất các tác dụng phụ nghiêm trọng ở những bệnh nhân điều trị với sitagliptin tương tự như bệnh nhân dùng placebo. Đánh giá về các biến chứng liên quan đến bệnh đái tháo đường xác định trước là tương đương giữa các nhóm bao gồm nhiễm trùng (18,4% ở bệnh nhân điều trị với JANUVIA và 17,7% ở bệnh nhân dùng giả dược), và suy thận (1,4% ở bệnh nhân điều trị với JANUVIA và 1,5% ở bệnh nhân dùng giả dược). Các tác dụng phụ ở bệnh nhân ≥ 75 tuổi nhìn chung tương tự với toàn bộ dân số nghiên cứu.
Trong quần thể có ý định điều trị, trong số những bệnh nhân đang sử dụng insulin và/hoặc một sulfonylurea, tỷ lệ hạ đường huyết nặng là 2,7% ở bệnh nhân điều trị với sitagliptin và 2,5% ở bệnh nhân dùng placebo; trong số các bệnh nhân đang không sử dụng insulin và/hoặc một sulfonylurea, tỷ lệ hạ đường huyết nặng là 1,0% ở bệnh nhân điều trị với sitagliptin và 0,7% ở bệnh nhân dùng placebo. Tần suất biến chứng viêm tụy đã được xác nhận là 0,3% ở bệnh nhân điều trị với sitagliptin và 0,2% ở bệnh nhân dùng placebo. Tần suất biến chứng khối u ác tính đã được xác nhận là 3,7% ở bệnh nhân điều trị với JANUVIA là 4,0% ở bệnh nhân dùng placebo.
THÔNG BÁO CHO BÁC SỸ HOẶC DƯỢC SỸ NHỮNG TÁC DỤNG KHÔNG MONG MUỐN GẶP PHẢI KHI SỬ DỤNG THUỐC
Các phát hiện về xét nghiệm
Tần suất các tác dụng bất lợi về kết quả xét nghiệm ở bệnh nhân dùng JANUVIA 100mg tương tự ở bệnh nhân dùng placebo. Trong các nghiên cứu lâm sàng chéo (across clinical studies), lượng bạch cầu tăng nhẹ (khác biệt xấp xỉ 200 tế bào bạch cầu/microL so với placebo; lượng bạch cầu trung bình ban đầu xấp xỉ 6.600 tế bào/microL) do tăng bạch cầu trung tính. Điều này được phát hiện ở hầu hết nhưng không phải ở tất cả các nghiên cứu. Sự thay đổi các thông số xét nghiệm này được xem không liên quan đến lâm sàng.
Tương tác với các thuốc khác
Trong các nghiên cứu tương tác thuốc, sitagliptin không gây tác động có ý nghĩa lâm sàng lên dược động học của các thuốc sau đây: metformin, rosiglitazone, glyburide, simvastatin, warfarin và viên uống tránh thai. Dựa vào các dữ liệu này, sitagliptin không ức chế các isozyme CYP là CYP3A4, 2C8, hoặc 2C9. Dựa vào dữ liệu in vitro, người ta cho rằng sitagliptin cũng không có tác dụng ức chế CYP2D6, 1A2, 2C19 hoặc 2B6, hoặc cảm ứng CYP3A4.
Dùng metformin liều lặp lại ngày 2 lần cùng với sitagliptin không làm thay đổi có ý nghĩa dược động học của sitagliptin ở bệnh nhân đái tháo đường týp 2.
Các phân tích dược động học theo dân số đã được tiến hành ở bệnh nhân đái tháo đường týp 2. Những thuốc dùng đồng thời không gây tác dụng có ý nghĩa lâm sàng lên dược động học của sitagliptin. Những thuốc được đánh giá là thuốc dùng phổ biến ở bệnh nhân đái tháo đường týp 2, bao gồm các thuốc trị tăng cholesterol máu (như statins, fibrates, ezetimibe), thuốc kháng tiểu cầu (như clopidogrel), thuốc trị tăng huyết áp (như thuốc ức chế men chuyển, chẹn thụ thể angiotensin, chẹn beta, ức chế kênh canxi, hydrochlorothiazide), thuốc giảm đau và kháng viêm không steroid (như naproxen, diclofenac, celecoxib), thuốc trị trầm cảm (như bupropion, fluoxetine, sertraline), kháng histamine (như cetirizine), ức chế bơm proton (như omeprazole, lansoprazole), và các thuốc trị rối loạn cương dương (như sildenafil).
Diện tích dưới đường cong và trung bình nồng độ đỉnh của digoxin tăng nhẹ (AUC, 11% và Cmax , 18%) khi dùng cùng sitagliptin, mức độ tăng này không được xem là có ý nghĩa lâm sàng. Nên giám sát bệnh nhân đang dùng digoxin cho thích hợp. Không khuyến cáo điều chỉnh liều digoxin hay JANUVIA.
Khi cho đối tượng này uống một liều đơn JANUVIA 100mg cùng với một liều đơn cyclosporin 600mg, vốn là chất ức chế mạnh p-glycoprotein, AUC và Cmax của sitagliptin tăng xấp xỉ 29% và 68%. Những thay đổi này trong dược động học của sitagliptin được xem không có ý nghĩa lâm sàng. Không khuyến cáo điều chỉnh liều JANUVIA khi dùng chung với cyclosporine hoặc các chất ức chế p-glycoprotein khác (như ketoconazole).
Quá liều
Trong những thử nghiệm lâm sàng có đối chứng người khỏe mạnh, JANUVIA liều đơn đến 800mg được dung nạp tốt. Trong một nghiên cứu dùng liều 800mg JANUVIA, khoảng QTc tăng rất ít và không liên quan đến lâm sàng (xem DƯỢC LÂM SÀNG, Dược lực học, Điện tim). Chưa có kinh nghiệm sử dụng các liều cao hơn 800mg ở người. Trong các nghiên cứu giai đoạn I về chế độ nhiều liều trong ngày, người ta không tìm thấy các phản ứng bất lợi trên lâm sàng liên quan đến liều khi dùng JANUVIA đến liều 600 mg/ngày trong 10 ngày và 400 mg/ngày đến 28 ngày.
Trong trường hợp quá liều, nên áp dụng các biện pháp hỗ trợ thường dùng, như loại bỏ chất chưa kịp hấp thu khỏi đường tiêu hóa, theo dõi trên lâm sàng (bao gồm làm điện tâm đồ) và trị liệu nâng đỡ, nếu cần.
Sitagliptin có thể được thẩm tách vừa phải. Trong nghiên cứu lâm sàng, khoảng 13.5% liều dùng được loại bỏ sau 3 - 4 giờ thẩm phân máu. Có thể xem xét thẩm phân máu kéo dài nếu phù hợp trên lâm sàng, vẫn chưa biết rõ thẩm phân phúc mạc có thể thẩm tách được sitagliptin hay không.
Lái xe và vận hành máy móc
Chưa thực hiện các nghiên cứu về tác động của JANUVIA lên khả năng lái xe và vận hành máy móc. Tuy nhiên, người ta cho rằng JANUVIA không ảnh hưởng đến khả năng lái xe và vận hành máy móc.
Thai kỳ và cho con bú
Phụ nữ có thai:
Sitagliptin không có khả năng gây quái thai ở chuột cống khi dùng liều lên đến 250 mg/kg hoặc ở thỏ liều lên đến 125 mg/kg trong giai đoạn hình thành các cơ quan (tương ứng lên đến 32 lần và 22 lần, lượng dung nạp ở người dựa theo liều đề nghị hàng ngày ở người lớn là 100 mg/ngày). Ở chuột cống, tỷ lệ biến dạng xương sườn thai nhi (không có xương sườn, xương sườn giảm sản và chuỗi hạt sườn) tăng nhẹ được ghi nhận khi chuột mẹ dùng liều 1000 mg/kg/ngày (khoảng 100 lần lượng dung nạp ở người dựa theo liều đề nghị hàng ngày ở người lớn là 100 mg/ngày). Khi chuột cống mẹ dùng liều uống 1000 mg/kg/ngày, cân nặng trung bình của chuột con cả 2 giống đực và cái trước khi thôi bú và sự tăng cân của chuột đực con sau khi thôi bú đều giảm nhẹ. Tuy nhiên, những nghiên cứu về sự sinh sản ở động vật không phải lúc nào cũng dự đoán được đáp ứng ở người.
Vì không có những nghiên cứu đầy đủ và đối chứng tốt ở phụ nữ có thai, nên chưa biết rõ tính an toàn của JANUVIA ở phụ nữ có thai. Như các thuốc uống trị tăng đường huyết khác, không khuyến cáo sử dụng JANUVIA trong thai kỳ.
Phụ nữ cho con bú:
Sitagliptin được bài tiết vào sữa chuột cống mẹ. Vẫn chưa biết rõ sitagliptin có bài tiết vào sữa người hay không. Do đó, không nên dùng JANUVIA cho phụ nữ đang cho con bú.
Bảo quản
Bảo quản ở nhiệt độ dưới 30°C (86°F).
Quy cách đóng gói
Hộp 2 vỉ x 14 viên nén bao phim.
Hạn dùng
36 tháng kể từ ngày sản xuất.
Dược lực học
Cơ chế tác động
JANUVIA thuộc nhóm thuốc uống trị tăng đường huyết, gọi là chất ức chế dipeptidyl peptidase 4 (DPP-4) có tác dụng cải thiện đường huyết ở bệnh nhân đái tháo đường týp 2 bằng cách làm tăng nồng độ các hormone incretin thể hoạt động. Các hormone incretin bao gồm peptide giống glucagon 1 (glucagon-like peptide-1: GLP-1) và polypeptide kích thích tiết insulin và phụ thuộc vào glucose (glucose-dependent insulinotropic polypeptide: GIP), được phóng thích từ ruột suốt ngày, và tăng nồng độ đáp ứng với bữa ăn. Các hormone incretin này là thành phần của hệ thống nội sinh tham gia vào sự điều hòa sinh lý tình trạng cân bằng nội môi glucose. Khi nồng độ glucose bình thường hoặc tăng cao, GLP-1 and GIP làm tăng sự tổng hợp và phóng thích insulin từ các tế bào beta tuyến tụy qua các đường truyền tín hiệu nội bào liên kết với AMP vòng. Người ta đã chứng minh việc điều trị với các chất ức chế GLP-1 hoặc với DPP-4 các mô hình động vật bị đái tháo đường týp 2 đã làm cải thiện đáp ứng của tế bào beta đối với glucose và kích thích sinh tổng hợp và phóng thích insulin. Sự hấp thu và sử dụng glucose tại mô gia tăng khi nồng độ insulin cao hơn. Ngoài ra, GLP-1 làm giảm tiết glucagon từ tế bào alpha tuyến tụy. Nồng độ glucagon giảm cùng với nồng độ insulin cao hơn dẫn đến giảm sản xuất glucose tại gan, gây giảm nồng độ glucose trong máu. Các tác dụng này của GLP-1 và GIP phụ thuộc vào glucose, vì vậy khi nồng độ glucose trong máu thấp, sự kích thích phóng thích insulin và ức chế tiết glucagon do GLP-1 không xảy ra. Đối với cả hai GLP-1 và GIP, khi nồng độ glucose cao hơn mức bình thường thì sự kích thích phóng thích insulin gia tăng. Hơn nữa, GLP-1 không làm suy giảm đáp ứng bình thường của glucagon đối với tình trạng đường huyết thấp. Hoạt tính của GLP-1 và GIP bị hạn chế bởi enzyme DPP-4, đây là enzyme nhanh chóng thủy phân các hormone incretin thành các chất không hoạt tính. Sitagliptin ngăn ngừa DPP-4 thủy phân các hormone incretin, do đó làm tăng nồng độ các dạng hoạt tính của GLP-1 và GIPtrong huyết tương. Bằng cách tăng nồng độ incretin dạng hoạt động, sitagliptin làm tăng phóng thích Insulin và giảm nồng độ glucagon theo cách thức phụ thuộc vào glucose. Ở bệnh nhân đái tháo đường týp 2 có tình trạng tăng đường huyết, sự thay đổi nồng độ insulin và glucagon này dẫn đến giảm nồng độ hemoglobin A1c (HbA1c) và nồng độ glucose lúc đói và sau khi ăn. Cơ chế phụ thuộc vào glucose này khác biệt với cơ chế tác dụng của các sulfamid hạ đường huyết; các sulfamid hạ đường huyết làm tăng tiết insulin ngay cả khi nồng độ glucose thấp và có thể dẫn đến hạ đường huyết ở bệnh nhân đái tháo đường týp 2 và ở đối tượng bình thường. Sitagliptin là 1 chất ức chế mạnh, chọn lọc cao trên enzyme DPP-4 và không ức chế các enzyme liên quan gần là DPP-8 hoặc DPP-9 ở các nồng độ điều trị.
Dược lực học
Tổng quát
Ở bệnh nhân đái tháo đường týp 2, các liều đơn JANUVIA dẫn đến ức chế hoạt tính của DPP-4 trong 24 giờ, gây tăng nồng độ GLP-1 và GIP thể hoạt động trong máu đến 2 - 3 lần, tăng nồng độ insulin và C-peptide trong huyết tương, giảm nồng độ glucagon, giảm glucose lúc đói, và giảm dung nạp glucose sau khi uống glucose hoặc sau bữa ăn.
Trong 1 nghiên cứu ở bệnh nhân đái tháo đường týp 2 không kiểm soát tốt với đơn trị liệu metformin, nồng độ glucose theo dõi suốt ngày đã giảm đáng kể ở bệnh nhân dùng liệu pháp kết hợp sitagliptin 100mg/ngày (50mg x 2 lần/ngày) với metformin, so với bệnh nhân dùng placebo với metformin (xem Hình 1).
Hình 1: Đặc điểm glucose huyết tương 24 giờ sau 4 tuần điều trị với Sitagliptin 50mg ngày 2 lần cùng Metformin hoặc Placebo với Metformin
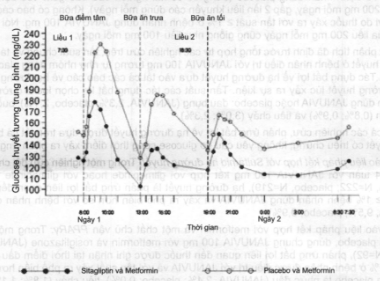
Trong các nghiên cứu lâm sàng giai đoạn III kéo dài 18 - 24 tuần, trị liệu JANUVIA 100 mg/ngày ở bệnh nhân đái tháo đường týp 2 làm cải thiện đáng kể chức năng tế bào beta, đánh giá qua một số các dấu ấn, bao gồm chỉ số HOMA-β (mô hình toán học - HOMA-β), tỉ số proinsulin/insulin, và đánh giá đáp ứng của tế bào beta từ xét nghiệm dung nạp bữa ăn với mẫu máu lấy thường xuyên.
Trong các nghiên cứu giai đoạn II, hiệu lực giảm đường huyết không tăng thêm khi dùng JANUVIA 50mg ngày 2 lần so với liều 100mg ngày 1 lần.
Một nghiên cứu ngẫu nhiên, đối chứng placebo, mù đôi, mù dạng thuốc, nghiên cứu bắt chéo 4 giai đoạn ở các đối tượng người lớn khỏe mạnh đã đánh giá các tác dụng lên nồng độ huyết tương sau bữa ăn của GLP-1 toàn phần và GLP-1 thể hoạt động, cũng như nồng độ glucose sau khi uống sitagliptin kết hợp với metformin so với sau khi uống sitagliptin đơn độc, metformin đơn độc, hoặc placebo trong 2 ngày. Sự gia tăng nồng độ trung bình của GLP-1 thể hoạt động đo 4 giờ sau bữa ăn đã tăng gần 2 lần sau khi dùng hoặc sitagliptin đơn độc hoặc metformin đơn độc, so với placebo. Tác dụng lên nồng độ GLP-1 có hoạt tính sau khi dùng sitagliptin cùng metformin đã tăng cộng lực, với nồng độ GLP-1 có hoạt tính tăng xấp xỉ 4 lần so với dùng placebo. Sitagliptin đơn trị liệu chỉ làm tăng nồng độ GLP-1 thể hoạt động, phản ánh sự ức chế DPP-4, trong khi đó metformin đơn độc làm tăng nồng độ GLP-1 toàn phần và có hoạt tính ở mức độ như nhau. Các dữ liệu này phù hợp với những cơ chế khác nhau về sự gia tăng nồng độ GLP-1 có hoạt tính. Kết quả từ nghiên cứu này cũng chứng minh sitagliptin, chứ không phải metformin, làm tăng nồng độ GIP có hoạt tính.
Trong các nghiên cứu ở đối tượng khỏe mạnh, JANUVIA không làm giảm thấp đường huyết hơn mức độ bình thường hoặc gây hạ đường huyết, điều này gợi ý các tác động kích thích tiết insulin và ức chế glucagon của thuốc này hoàn toàn phụ thuộc vào glucose.
Tác dụng lên huyết áp
Trong một nghiên cứu ngẫu nhiên, đối chứng placebo, nhóm bắt chéo ở bệnh nhân tăng huyết áp đang dùng một hoặc nhiều thuốc trị tăng huyết áp (bao gồm các các thuốc ức chế men chuyển angiotensin, thuốc đối kháng angiotensin-II, ức chế kênh canxin, chẹn beta và lợi tiểu), JANUVIA dùng chung với các thuốc này thường dung nạp tốt. Ở các bệnh nhân này, JANUVIA có tác dụng giảm huyết áp vừa phải; JANUVIA liều 100mg/ngày làm giảm mức huyết áp tâm thu trung bình đo di động suốt 24 giờ đến gần 2mmHg, khi so với placebo. Tác dụng giảm huyết áp này không xảy ra ở đối tượng có huyết áp bình thường.
Điện tim
Trong một nghiên cứu ngẫu nhiên, đối chứng placebo, nhóm bắt chéo trên 79 đối tượng khỏe mạnh dùng một liều đơn JANUVIA 100mg, JANUVIA 800mg (8 lần liều khuyến cáo) và placebo, ở liều khuyến cáo 100mg, không xảy ra tác động lên khoảng QTc khi thuốc đạt nồng độ đỉnh trong huyết tương, hoặc vào bất kỳ thời điểm khác trong nghiên cứu. Sau khi dùng liều 800mg, mức độ tăng tối đa về sự thay đổi trung bình khoảng QTc hiệu chỉnh theo placebo so với mức ban đầu sau 3 giờ uống thuốc là 8,0 mili giây. Sự gia tăng nhỏ này không được xem là có ý nghĩa lâm sàng. Ở liều 800mg, nồng độ đỉnh của sitagliptin huyết tương cao hơn gần 11 lần so với nồng độ đỉnh của liều 100mg.
Ở bệnh nhân đái tháo đường týp 2 dùng JANUVIA 100mg (N = 81) hoặc JANUVIA 200mg (N = 63) mỗi ngày, khoảng QTc thay đổi không có ý nghĩa dựa theo dữ liệu ECG tại thời điểm đạt nồng độ đỉnh thường gặp trong huyết tương.
Dược động học
Dược động học của Sitagliptin được nghiên cứu sâu rộng ở đối tượng khỏe mạnh và ở bệnh nhân đái tháo đường týp 2. Ở đối tượng khỏe mạnh uống dùng 1 liều 100mg, sitagliptin được hấp thu nhanh chóng đạt nồng độ đỉnh trong huyết tương (trung vị Tmax) 1 - 4 giờ sau khi uống thuốc. AUC của sitagliptin trong huyết tương gia tăng tương ứng theo liều dùng, ở người tình nguyện khỏe mạnh sau khi uống 1 liều đơn 100mg, AUC trung bình của sitagliptin trong huyết tương là 8,52 µM•giờ, Cmax là 950 nM, và nửa đời thải trừ cuối cùng biểu kiến (t1/2) là 12.4 giờ. AUC của sitagliptin huyết tương tăng xấp xỉ 14% sau khi dùng các liều 100mg ở trạng thái bền vững so với dùng liều đầu tiên. Hệ số tương quan về AUC của sitagliptin ở từng đối tượng và giữa các đối tượng đều nhỏ (5.8% so với 15.1%). Dược động học của sitagliptin nói chung đều giống nhau ở đối tượng khỏe mạnh và ở bệnh nhân đái tháo đường týp 2.
Hấp thu
Sinh khả dụng tuyệt đối của sitagliptin khoảng 87%. Do uống thuốc trong bữa ăn nhiều chất béo không ảnh hưởng đến tác động lên dược động học của JANUVIA dùng cùng lúc, nên có thể dùng JANUVIA cùng hoặc không cùng với thức ăn (lúc bụng no hoặc bụng đói).
Phân phối
Thể tích phân phối trung bình ở trạng thái bền vững sau khi dùng 1 liều đơn sitagliptin 100mg đường tĩnh mạch ở đối tượng khỏe mạnh thì khoảng 198 lít. Tỷ lệ sitagliptin gắn kết thuận nghịch với các protein huyết tương thì thấp (38%).
Chuyển hóa
Sitagliptin được đào thải chủ yếu trong nước tiểu ở dạng không thay đổi và một phần nhỏ qua đường chuyển hóa. Gần 79% sitagliptin được thải trong nước tiểu ở dạng không thay đổi.
Sau khi uống 1 liều sitagliptin có đánh dấu [14C], khoảng 16% chất có tính phóng xạ là các chất chuyển hóa của Sitagliptin. Sáu chất chuyển hóa này được phát hiện ở nồng độ vết và được cho là không liên quan đến hoạt tính ức chế DPP-4 huyết tương của sitagliptin. Những nghiên cứu in vitro đã chứng minh enzyme chủ yếu chịu trách nhiệm cho sự chuyển hóa hạn chế của sitagliptin là CYP3A4, với sự góp phần của CYP2C8.
Thải trừ
Sau khi các đối tượng khỏe mạnh uống 1 liều sitagliptin [14C], khoảng 100% chất có tính phóng xạ được thải trong phân (13%) hoặc nước tiểu (87%) trong 1 tuần dùng thuốc. Nửa đời thải trừ cuối cùng biểu kiến sau khi uống 1 liều sitagliptin 100mg thì xấp xỉ 12.4 giờ và sự thanh thải qua thận khoảng 350 mL/phút.
Sitagliptin được đào thải chủ yếu qua thận với sự bài tiết chủ động qua ống thận. Sitagliptin là 1 chất nền đối với chất chuyên chở anion hữu cơ 3 ở người (human organic anion transporter-3: hOAT-3), vốn là chất có thể tham gia vào sự thải trừ Sitagliptin qua thận, vẫn chưa xác định được sự liên quan lâm sàng của hOAT-3 trong vận chuyển sitagliptin. Sitagliptin cũng là 1 chất nền của p-glycoprotein, mà chất này cũng có thể tham gia vào quá trình đào thải sitagliptin qua thận. Tuy nhiên, cyclosporine, một chất ức chế p-glycoprotein không lảm giảm sự thanh thải sitagliptin qua thận.
Các đặc tính ở bệnh nhân
Suy thận: Một nghiên cứu mở liều đơn, nhãn mở được tiến hành để đánh giá dược động học của JANUVIA (liều 50mg) ở các bệnh nhân suy thận mãn tính với các mức độ khác nhau so với đối tượng khỏe mạnh, chức năng thận bình thường. Nghiên cứu này gồm các bệnh nhân phân loại suy thận mức độ nhẹ, trung bình và nặng, cũng như các bệnh nhân bị bệnh thận giai đoạn cuối đang được thẩm phân máu. Ngoài ra, ảnh hưởng của suy thận trên dược động học của sitagliptin ở bệnh nhân bị đái tháo đường tuýp 2 và suy thận nhẹ, trung bình hoặc nặng (bao gồm cả bệnh thận giai đoạn cuối) đã được đánh giá bằng các phân tích dược động học theo dân số.
So sánh với các đối tượng khỏe mạnh bình thường, AUC của sitagliptin trong huyết tương đã tăng khoảng 1,2 lần và 1,6 lần ở bệnh nhân suy thận nhẹ (eGFR ≥ 60 mL/phút/1,73m2 đến < 90 mL/phút/1,73m2) và bệnh nhân suy thận trung bình (eGFR ≥ 45 mL/phút/1,73m2 đến < 60 mL/phút/1,73m2) theo thứ tự tương ứng. Do sự gia tăng này không liên quan đến lâm sàng nên không cần thiết phải điều chỉnh liều ở những bệnh nhân này.
AUC của sitagliptin trong huyết tương đã tăng khoảng 2 lần ở bệnh nhân suy thận trung bình (eGFR ≥ 30 mL/phút/1,73m2 đến < 45 mL/phút/1,73m2), và tăng khoảng 4 lần ở bệnh nhân suy thận nặng (eGFR < 30 mL/phút/1,73m2), bao gồm bệnh nhân có bệnh thận giai đoạn cuối đang được thẩm phân máu.
Sitagliptin được loại bỏ vừa phải qua thẩm phân máu (13.5% sau 3 - 4 giờ thẩm phân máu, bắt đầu thẩm phân sau khi uống thuốc được 4 giờ). Để đạt nồng độ sitagliptin trong huyết tương tương tự như ở bệnh nhân có chức năng thận bình thường, nên dùng liều thấp hơn ở bệnh nhân có eGFR < 45 mL/phút/1,73m2. (xem LIỀU LƯỢNG VÀ CÁCH DÙNG, Bệnh nhân suy thận).
Suy gan: Ở bệnh nhân suy gan trung bình (điểm số Child-Pugh 7 - 9), giá trị trung bình AUC và Cmax của sitagliptin tăng, lần lượt, khoảng 21% và 13%, so với các nhóm chứng tương ứng khỏe mạnh sau khi dùng 1 liều đơn JANUVIA 100mg. Các khác biệt này được xem không có ý nghĩa lâm sàng. Không cần chỉnh liều JANUVIA đối với bệnh nhân suy gan nhẹ hoặc trung bình.
Không có kinh nghiệm lâm sàng ở bệnh nhân bị suy gan nặng (điểm số Child-Pugh > 9). Tuy nhiên, vì Sitagliptin chủ yếu được đào thải qua thận, nên theo dự đoán suy gan nặng không tác động lên dược động học của sitagliptin.
Người cao tuổi: Không cần chỉnh liều theo tuổi. Tuổi tác không gây tác động có ý nghĩa lâm sàng lên dược động học của sitagliptin dựa theo 1 phân tích dược động học theo dân số từ dữ liệu giai đoạn I và giai đoạn II. Đối tượng cao tuổi (65 - 80 tuổi) có nồng độ sitagliptin huyết tương cao hơn 19% so với đối tượng trẻ tuổi hơn.
Trẻ em: Chưa có nghiên cứu JANUVIA tiến hành ở trẻ em.
Giới tính: Không cần chỉnh liều theo giới tính. Giới tính không gây tác động có ý nghĩa lâm sàng lên dược động học của sitagliptin dựa theo 1 phân tích tổng hợp từ các dữ liệu dược động học giai đoạn I và theo 1 phân tích dược động học dân số từ dữ liệu lâm sàng giai đoạn I và II.
Chủng tộc: Không cần chỉnh liều theo chủng tộc. Chủng tộc không gây tác động có ý nghĩa lâm sàng lên dược động học của sitagliptin dựa theo 1 phân tích tổng hợp từ các dữ liệu dược động học giai đoạn I và theo 1 phân tích dược động học dân số từ dữ liệu lâm sàng giai đoạn I và II, bao gồm các đối tượng người da trắng, Tây Ban Nha, da đen, da vàng Châu Á và các nhóm chủng tộc khác.
Chỉ số khối cơ thể (BMI): Không cần chỉnh liều theo BMI. Chỉ số khối cơ thể không gây tác động có ý nghĩa lâm sàng lên dược động học của sitagliptin dựa theo 1 phân tích tổng hợp từ các dữ liệu dược động học giai đoạn I và theo 1 phân tích dược động học dân số từ dữ liệu lâm sàng giai đoạn I và II.
Đái tháo đường týp 2: Dược động học của sitagliptin ở bệnh nhân đái tháo đường týp 2 thường tương tự như ở đối tượng khỏe mạnh.
Đặc điểm
JANUVIA (sitagliptin phosphate) là thuốc ức chế mạnh, chọn lọc cao trên enzyme dipeptidyl peptidase 4 (DPP-4), có hiệu lực ở dạng uống dùng để điều trị bệnh đái tháo đường týp 2. Các thuốc ức chế DPP-4 là 1 nhóm thuốc có tác dụng làm tăng nồng độ incretin. Bằng cách ức chế enzyme DPP-4, sitagliptin làm tăng nồng độ của 2 hormone incretin hoạt động đã được biết rõ, là peptide giống glucagon 1 (glucagon-like peptide 1: GLP-1) và polypeptide kích thích tiết insulin và phụ thuộc vào glucose (glucose-dependent insulinotropic polypeptide: GIP). Các hormone incretin này là thành phần của hệ thống nội sinh tham gia điều hòa sinh lý tình trạng cân bằng nội môi glucose. Khi nồng độ glucose trong máu bình thường hoặc tăng cao, GLP-1 và GIP làm tăng tổng hợp và phóng thích insulin từ các tế bào beta tuyến tụy. GLP-1 cũng làm giảm tiết glucagon từ các tế bào alpha tuyến tụy, dẫn đến giảm sản xuất glucose tại gan. Cơ chế này không giống như cơ chế tác dụng của các sulfamid hạ đường huyết, các sulfamid hạ đường huyết gây phóng thích insulin ngay cả khi nồng độ glucose thấp, điều này có thể dẫn đến hạ đường huyết do sulfamid hạ đường huyết ở bệnh nhân đái tháo đường týp 2 và ở người bình thường. Sitagliptin là một chất ức chế mạnh, rất chọn lọc enzyme DPP-4 và không ức chế các enzyme liên quan gần là DPP-8 hoặc DPP-9 ở các nồng độ điều trị. Sitagliptin có cấu trúc hóa học và tác dụng dược lý khác với các chất đồng vận GLP-1, insulin, sulfamide hạ đường huyết hoặc nhóm meglitinides, biguanides, chất chủ vận thụ thể gamma được hoạt hóa bởi yếu tố tăng trưởng peroxisome (peroxisome proliferator-activated receptor gamma -PPARγ), các chất ức chế alpha-glucosidase và các chất đồng vận amylin.
Thông tin khác
Sử dụng ở trẻ em:
Chưa xác lập tính an toàn và hiệu lực của JANUVIA ở bệnh nhi dưới 18 tuổi.
Sử dụng ở người cao tuổi:
Trong các nghiên cứu lâm sàng, tính an toàn và hiệu lực của JANUVIA ở người cao tuổi ( ≥ 65 tuổi) tương tự như ở bệnh nhân trẻ tuổi hơn (< 65 tuổi). Không cần chỉnh liều theo độ tuổi. Bệnh nhân cao tuổi có nhiều khả năng suy thận hơn; như các bệnh nhân khác, có thể cần chỉnh liều khi có suy thận đáng kể (xem LIỀU LƯỢNG VÀ CÁCH DÙNG, Bệnh nhân suy thận).